
Выживаемость биологической терапии в условиях реальной клинической практики
Выберите надежное лечение для ваших пациентов[1][2], проверенное в условиях реальной клинической практики[3]

Александр Эгеберг, доктор медицины, старший консультант отделения дерматологии в больнице Биспебьер, профессор университета Копенгагена в Дании, расскажет о понятии «выживаемость терапии» на примере общенационального датского реестра Dermbio
Выживаемость биологической терапии при псориазе — комплексный показатель, который включает в себя долгосрочную эффективность, безопасность, переносимость и приверженность пациента к терапии[3]
Новые данные реальной клинической практики, полученные из регистра BADBIR, продемонстрировали самую высокую выживаемость терапии препаратом ТРЕМФЕЯ, связанную с[3]:
Эффективностью
Безопасностью (наряду с устекинумабом)
по сравнению с другими биологическими препаратами*
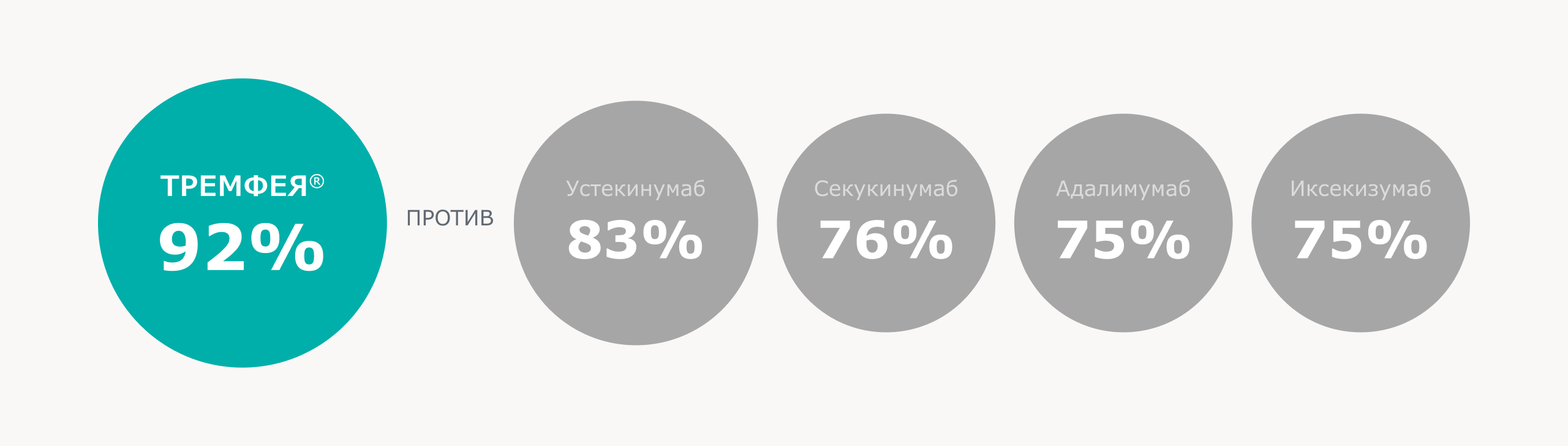
Препарат Тремфея продемонстрировал самые высокие результаты по выживаемости терапии, связанные с эффективностью через 2 года лечения, по сравнению с другими биологическими препаратами[3]*
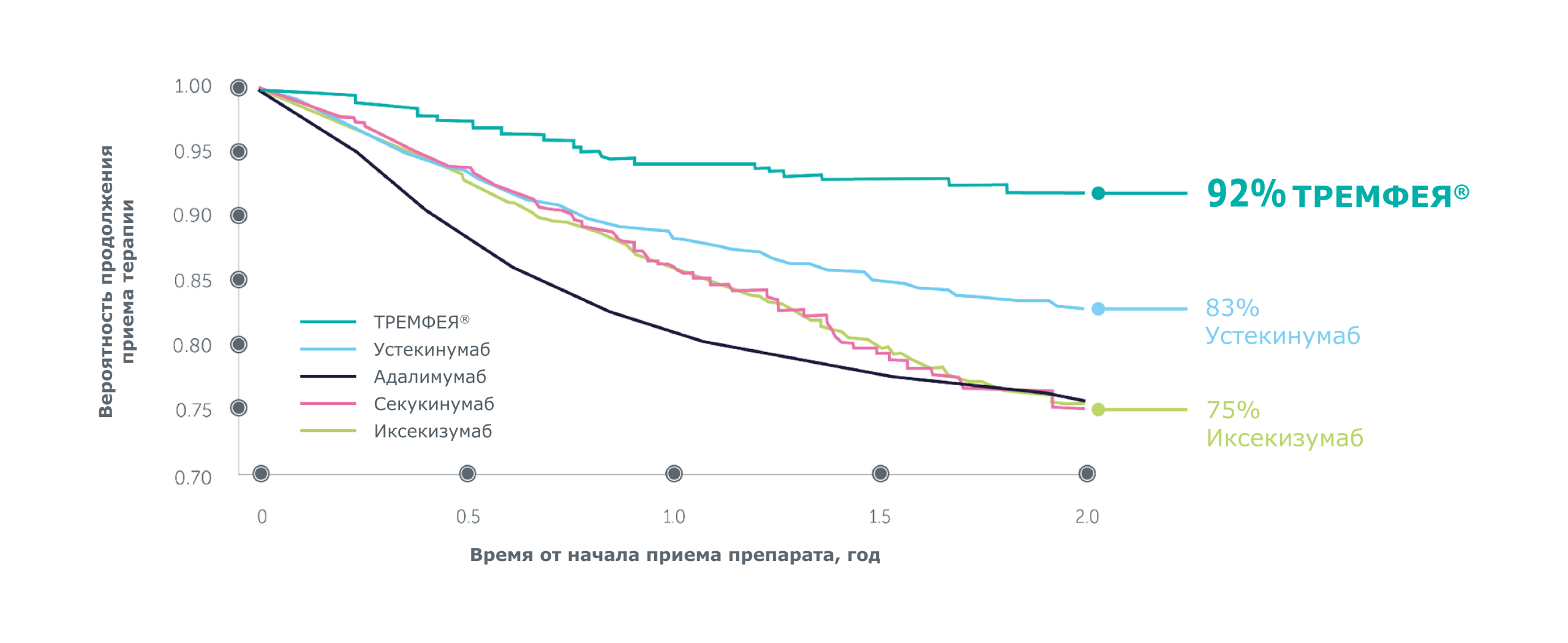
Выживаемость биологической терапии в условиях реальной клинической практики через 2 года[3]:
Выберите препарат Тремфея для бионаивных пациентов, что обеспечить их эффективным и долгосрочным лечением[3]
Через два года применения препарата ТРЕМФЕЯ у бионаивных пациентов была достигнута самая высокая выживаемость терапии*, связанная с эффективностью, по сравнению с другими биологическими препаратами[3]
Препарат Тремфея имеет обширную доказательную базу из регистров и данных реальной клинической практики, включая регистры DERMBIO, PERSIS и FINGUS... и количество данных продолжает расти[3][4][5][6]
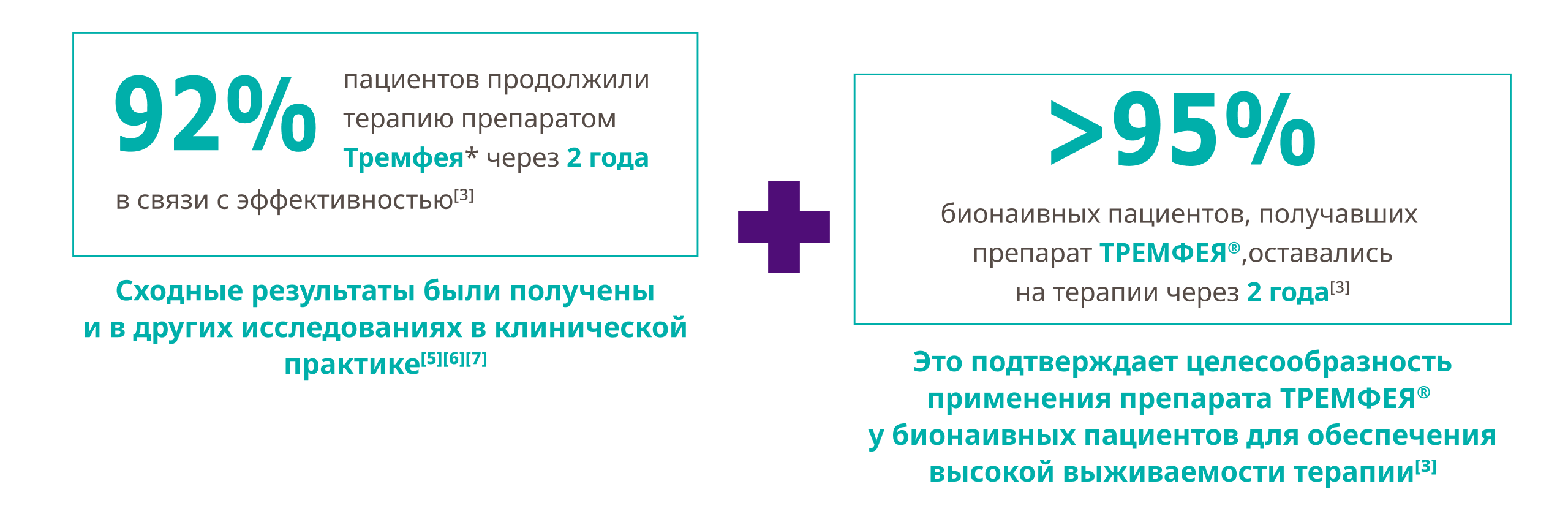
Добейтесь эффективного и долгосрочного контроля заболевания у бионаивных пациентов с помощью препарата ТРЕМФЕЯ[3]
Из 16 122 курсов лечения пациентов, включенных в исследование, 6 607 (41,0%) применяли адалимумаб, 5 405 (33,5%) — устекинумаб, 2 677 (16,6%) — секукинумаб, 730 (4,5%) — препарат Тремфея и 703 (4,4%) — иксекизумаб.
Применяйте препарат Тремфея у бионаивных пациентов как эффективную и долгосрочную терапию для контроля заболевания... независимо от факторов, влияющих на эффективность[3]
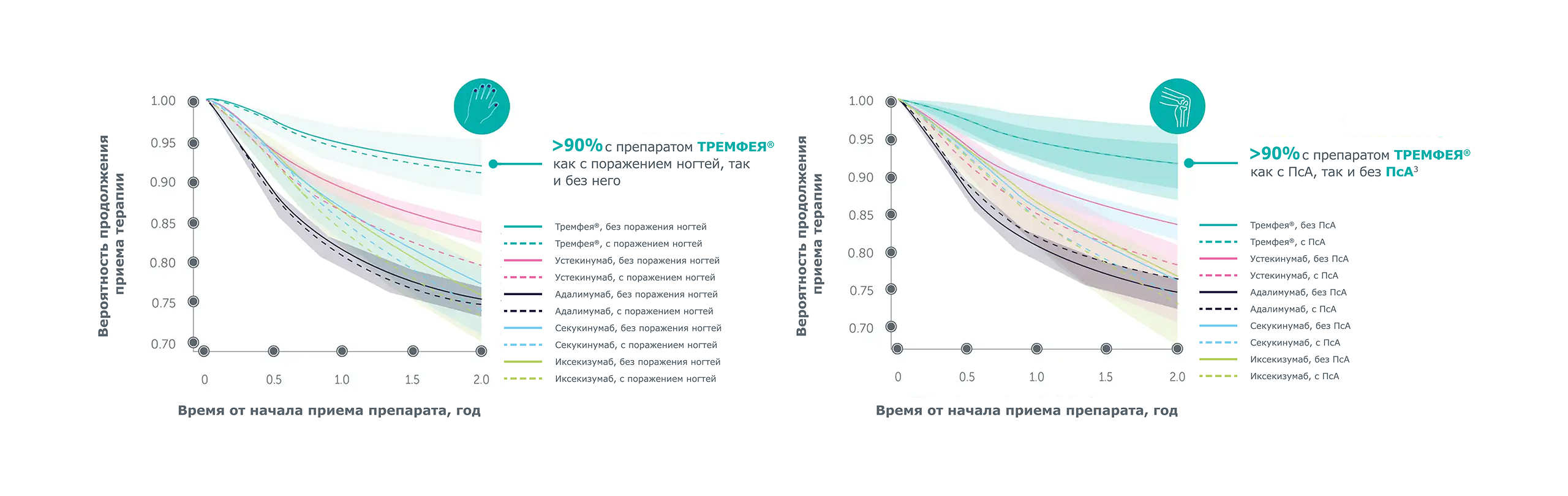
Через 2 года препарат ТРЕМФЕЯ демонстрировал самые высокие показатели выживаемости терапии* у пациентов, как с поражением ногтей и наличием ПсА, так и без поражения ногтей и без ПсА по сравнению с другими биологическими препаратами[3]
Усредненные для популяции кривые выживаемости терапии на основе ГПМ
Препарат Тремфея имеет обширную доказательную базу из регистров и данных реальной клинической практики, включая регистры DERMBIO, PERSIS и FINGUS... и количество данных продолжает расти[3][4][5][6]

Добейтесь эффективного и долгосрочного контроля заболевания у бионаивных пациентов с помощью препарата ТРЕМФЕЯ[3]
Из 16 122 курсов лечения пациентов, включенных в исследование, 6 607 (41,0%) применяли адалимумаб, 5 405 (33,5%) — устекинумаб, 2 677 (16,6%) — секукинумаб, 730 (4,5%) — препарат Тремфея и 703 (4,4%) — иксекизумаб.
Применяйте препарат Тремфея у бионаивных пациентов для достижения эффективного и длительного контроля над заболеванием[1][3]
Через 2 года препарат ТРЕМФЕЯ демонстрировал самые высокие показатели выживаемости терапии, связанной с безопасностью*, по сравнению с другими биологическими препаратами, наряду с устекинумабом
Выживаемость биологической терапии в условиях реальной клинической практики через 2 года[3]:

Применяйте препарат Тремфея у Ваших пациентов с псориазом, чтобы снизить возможность прерывания терапии в результате появления НЯ[2][3]
Препарат Тремфея имеет обширную доказательную базу из регистров и данных реальной клинической практики, включая регистры DERMBIO, PERSIS и FINGUS... и количество данных продолжает расти[3][4][5][6]

Из 16 122 курсов лечения пациентов, включенных в исследование, 6 607 (41,0%) применяли адалимумаб, 5 405 (33,5%) — устекинумаб, 2 677 (16,6%) — секукинумаб, 730 (4,5%) — препарат Тремфея и 703 (4,4%) — иксекизумаб.
Вам может быть интересно:

Узнайте, как меняется качество жизни пациентов в результате терапии препаратом Тремфея

Вульгарный псориаз, прогрессирующая стадия, внесезонная форма, тяжелой степени тяжести PASI — 22; BSA- 59%
Узнайте, как меняется качество жизни пациентов с псориазом проблемной локализации на терапии препаратом Тремфея
НЯ — нежелательные явления
KM — Каплан-Мейер
BADBIR — Регистр Британской ассоциации дерматологов по биологическим препаратам и иммуномодуляторам
ДИ — доверительный интервал
ГПМ — гибкая параметрическая модель
ПсА — псориатический артрит
Использованная литература
[1] Reich K, et al. Five-year maintenance of clinical response and improvements in health-related quality of life in patients with moderate-to-severe psoriasis treated with guselkumab: results from VOYAGE 1 and VOYAGE 2. Br J Dermatol 2021;185(6):1146–1159
[2] Blauvelt A, et al. Consistent safety profile with up to 5 years of continuous treatment with guselkumab: Pooled analyses from the phase 3 VOYAGE 1 and VOYAGE 2 trials of patients with moderate-to-severe psoriasis. J Am Acad Dermatol 2022;86(4):827–834
[3] Yiu ZZN, et al. Drug Survival Associated With Effectiveness and Safety of Treatment With Guselkumab, Ixekizumab, Secukinumab, Ustekinumab, and Adalimumab in Patients With Psoriasis. JAMA Dermatol. 2022;e222909. doi: 10.1001/jamadermatol.2022.2909
[4] Egeberg A, et al. Drug survival of biologics and novel immunomodulators for rheumatoid arthritis, axial spondyloarthritis, psoriatic arthritis, and psoriasis - Anationwide cohort study from the DANBIO and DERMBIO registries. Sem Arthritis Rheum 2022;151979
[5] Gerdes S, et al. Real-world evidence from the non-interventional, prospective, German multicentre PERSIST study of patients with psoriasis after 1 year of treatment with guselkumab. J Eur Acad Dermatol Venereol 2022:DOI:10.111/jdv.18218
[6] Mälkönen T, et al. Guselkumab Treatment Outcomes and Persistence in a Nationwide Real-world Cohort of Patients with Plaque Psoriasis. Acta Derm Venereol 2022;102:adv00631. doi: 10.2340/actadv.v101.910